
Registri di monitoraggio AIFA
Data di pubblicazione: 09 aprile 2018
I Registri dei farmaci sottoposti a monitoraggio sono uno strumento necessario per verificare l’appropriatezza prescrittiva dei farmaci dopo l’autorizzazione all’immissione in commercio.
Introdotti dall’Agenzia Italiana del Farmaco (AIFA) nel 2005, questi registri coinvolgono diverse aree terapeutiche e specialistiche e possono essere considerati la rappresentazione della real clinical practice.
La loro costituzione ha imposto una rivoluzione metodologica nella rimborsabilità dei nuovi medicinali da parte del SSN.
L’aspetto più innovativo di questa procedura consiste da un lato nella possibilità di migliorare la tutela del paziente, favorendo l’uso appropriato dei farmaci, e dall’altro nella possibilità di predire il numero di pazienti responders e/o failures al follow-up (pazienti in progressione).
La gestione centralizzata dei registri ha, inoltre, uniformato i flussi e le procedure a livello nazionale, al fine di ottenere dati statisticamente attendibili sull’uso dei farmaci e sulla loro tossicità.

I registri consentono anche di verificare i dati di spesa in base alle analisi delle prescrizioni e dei dati di outcome, e creano le condizioni per contrattare il costo dei farmaci in relazione alla loro efficacia nel tempo. Il sistema informatizzato coinvolge i direttori sanitari, i medici e i farmacisti nella gestione e nel controllo dell’appropriatezza d’uso, semplificando l’iter burocratico di comunicazione delle informazioni tra strutture e Autorità competenti.
I Registri di monitoraggio nascono, con il supporto di una piattaforma web prodotta in collaborazione con il Consorzio Interuniversitario Cineca, come è avvenuto ad esempio nel caso dei “Registri per i farmaci oncologici”.
L’obiettivo iniziale era di informatizzare la gestione del processo relativo alla richiesta, alla dispensazione e all’analisi dei dati di consumo per una specifica classe di farmaci, quelli oncologici, di cui l’AIFA aveva previsto la registrazione di schede-pazienti e la verifica dell’appropriatezza d’uso e dell’efficacia.
Con il D.L. del 6 luglio 2012 n. 95, poi convertito, con modificazioni, nella legge n. 135 del 7 agosto successivo, si è provveduto a garantire l’attivazione e il funzionamento dei registri dei farmaci sottoposti a monitoraggio e l’attivazione delle procedure per ottenere l’eventuale rimborso da parte delle aziende farmaceutiche interessate.
I registri sono così entrati ufficialmente a far parte del sistema informatico del Servizio Sanitario Nazionale (SSN) e, a partire dal primo gennaio 2013, l’AIFA ha avviato un nuovo sistema informativo, finalizzato all’automazione di tutti i flussi di tipo amministrativo-contabile e tecnico-sanitario, che ha consentito di semplificare le procedure, ottimizzare le risorse e proseguire nel processo avviato dall’Agenzia per una maggiore trasparenza amministrativa.
I Registri sono destinati a tutti i medicinali o alle nuove indicazioni terapeutiche che richiedono un monitoraggio addizionale, data la complessità della patologia per i quali sono stati sviluppati e gli esiti dei trial di registrazione (studi clinici di Fase III) non sufficienti a confermare il rapporto rischio/beneficio.
Tale monitoraggio addizionale può indurre modificazioni dei profili di efficacia dei farmaci analizzati alla luce di evidenze che emergono dal loro impiego nella pratica clinica quotidiana (real world evidence).
Generalmente, si tratta di farmaci ad alto costo, molti dei quali biologici (o biotecnologici), con procedura autorizzativa centralizzata e per i quali il rapporto rischio-beneficio può variare anche in modo significativo. Quest’ultimo aspetto sottolinea la volontà, a livello internazionale, di rendere accessibili in tempi brevi trattamenti farmacologici che rappresentato una reale innovazione terapeutica, soprattutto per quelle patologie definite ad alto costo, sociale ed economico.
I registri attivi al 2018 sono circa 147 e comprendono tanto i farmaci antineoplastici che quelli orfani, antipsoriasici, anti-epatite C da HCV, antidiabetici e per il sistema cardiovascolare.
Collegandosi al link https://servizionline.aifa.gov.it/ è possibile trovare il servizio relativo ai Registri, che risulta accessibile con credenziali.
Oltre ai Registri esistono, tuttavia, anche altri strumenti per monitorare l’appropriatezza e orientare le prescrizioni, vale a dire i Piani Terapeutici e le Note AIFA. In molti casi, il controllo avviene integrando i diversi sistemi. I Registri non sono quindi l’unico mezzo, ma senz’altro il più completo. In questo modo è possibile dare un’informazione e una guida all’appropriatezza prescrittiva, velocizzare le richieste di farmaco e tutti i processi interni ai centri prescrittori e, infine, poter tracciare in modo sicuro l’uso e la spesa farmaceutica da parte di strutture ospedaliere.
Tipologia di registri ed accordi
1. I Registri e i Piani terapeutici web based dei medicinali sottoposti a monitoraggio AIFA sono divisi in 3 tabelle:
- Attivi, Registri e Piani terapeutici web based attualmente online sulla piattaforma web;
- In Arrivo, Registri e Piani terapeutici web based che verranno implementati sulla piattaforma web;
- Chiusi, Registri e Piani terapeutici web based con monitoraggio terminato.
I Registri attualmente attivi e consultabili online si dividono in tre tipologie:
- Drug-product Registry (DPR);
- Drug-product Therapeutic Area Registry (DP TAR);
- Piano Terapeutico (PT).
2. Per i farmaci sottoposti a Registro di Monitoraggio, AIFA ha stipulato con l’industria farmaceutica accordi di risk sharing, o condivisione del rischio in caso di fallimento di un trattamento terapeutico. Il principio che guida questi accordi è di rimborsare il farmaco innovativo in base alla sua efficacia, lasciando nei casi di fallimento terapeutico (failures) il costo della terapia a carico dell’azienda produttrice.
Le tipologie degli accordi, definite Managed Entry Agreements (MEAs), sono identificante in due categorie:
- Accordo finanziario (Financial-based): Cost sharing, capping o payback;
- Accordo basato su outcome o beneficio clinico atteso dal nuovo farmaco (Performance-based risk sharing): Payment by result, Success fee, Risk sharing.
Cost Sharing (CS)
Prevede uno sconto sul prezzo dei primi cicli di terapia per tutti i pazienti eleggibili al trattamento, così come individuati dal “Riassunto delle Caratteristiche del Prodotto”. Successivamente, verificato il grado di rispondenza alla cura da parte dei destinatari, sono esclusi i pazienti per i quali il medicinale non si sia rivelato efficace invece, il prezzo di cessione viene, mantenuto per i cicli di cura relativi ai soggetti che beneficiano realmente del trattamento. L’azienda sanitaria acquisisce un risparmio certo, immediato e generalizzato, che prescinde dal risultato clinico sul singolo paziente. L’azienda ottiene che, definito il prezzo rimborsabile con AIFA, il proprio farmaco possa esser somministrato su un campione allargato di pazienti.
Capping/payback
Gli accordi di Capping/payback prevedono il contributo totale a carico dell’Azienda Farmaceutica laddove l’erogazione del farmaco supera le quantità stabilite dall’accordo negoziale. Pertanto, sono a carico dell’SSN i soli trattamenti (e quindi le confezioni) previsti dall’accordo negoziale, mentre ogni successivo trattamento o confezione è rimborsato dall’Azienda Farmaceutica.
Payment by result (PbR)
Estende le modalità del risk sharing, prevedendo un rimborso totale da parte dell’azienda farmaceutica a tutti i pazienti che non rispondono al trattamento (payback da parte delle Aziende Farmaceutiche del 100% dei fallimenti terapeutici). In sede di acquisto alle strutture sanitarie viene applicato il prezzo pieno, successivamente è valutata l’efficacia del medicinale, una volta somministrati i cicli di terapia necessari per definirla; i pazienti non responders vengono esclusi dai trattamenti con quel farmaco e l’azienda ha l’obbligo di restituire il corrispondente importo ricevuto attraverso il meccanismo contabile della nota di credito. L’onere del farmaco in questo modo viene assunto interamente a carico del produttore qualora non avesse conseguito il risultato terapeutico atteso nel periodo previsto. Questa tipologia di rimborso è prevista per i farmaci per cui il bilancio rischio-beneficio è ancora incerto e i cui dati a disposizione in termini di efficacia sono ancora in fase di raccolta.
Success fee
Introdotto nel 2013, prevede un rimborso a posteriori del 100% del successo terapeutico. Tale accordo prevede che il SSN ottenga il medicinale dall’Azienda titolare inizialmente a titolo gratuito e, poi, alla valutazione della risposta al trattamento (al follow-up, esclusivamente nei casi di successo terapeutico), provveda a remunerare le corrispondenti confezioni dispensate.
Risk Sharing (RS)
Rispetto al cost sharing, prevede uno sconto che si applica esclusivamente ai pazienti non rispondenti al trattamento. I medici effettuano la valutazione dell’evoluzione della patologia e, in relazione ai soggetti rispondenti il prezzo di acquisto per gli ulteriori cicli, viene mantenuto al livello stabilito nell’accordo iniziale, mentre gli altri pazienti vengono esclusi dalla continuazione del trattamento (per questi l’azienda rimborsa direttamente alla struttura ospedaliera la metà del costo sostenuto).
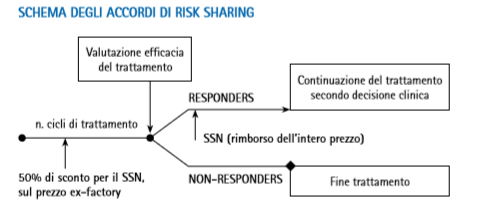
L’applicazione del criterio del Risk Sharing prevede l’implementazione di un complesso sistema di monitoraggio e controllo per la gestione dei flussi informativi e delle relative scelte di rimborsabilità.
Contratti e accordi negoziali
Si articolano in due fasi distinte.
- Inizialmente l’AIFA contratta e definisce con i produttori non solo il prezzo rimborsabile, le condizioni di acquisto ad opera delle aziende sanitarie e i criteri da cui dipende la verifica sull’efficacia del medicinale, ma anche i parametri clinici in base ai quali le imprese devono eventualmente restituire agli enti acquirenti gli importi ricevuti.
- In un secondo momento, invece, le strutture sanitarie espletano concretamente le procedure di acquisto, fruiscono degli sconti predeterminati dall’AIFA, e, infine, in base ai risultati dei trattamenti terapeutici, sono legittimate a esigere direttamente dalle imprese quanto dovuto in caso di fallimento terapeutico.
L’applicazione degli accordi negoziali enunciati dipende dei Registri di Monitoraggio, differenziati per patologia e finalizzati a garantire dati di efficacia e sicurezza del farmaco omogenei e oggettivi, così da permettere la valutazione dell’impatto terapeutico ed economico dei farmaci ad alto costo. Viene applicata la metodologia Value Based Price, che rapporta il risultato clinico conseguito al prezzo del farmaco, relativizzandolo in una logica di costo-efficacia. L’esito dei Managed Entry Agreements può risultare nella restituzione totale o parziale da parte dell’Azienda Farmaceutica del valore commerciale dei medicinali ad esempio nel momento in cui i pazienti non rispondono al trattamento. In questo caso si parla di payback verso le Regioni.
Approfondimento – L’innovazione terapeutica
Essa rappresenta un obiettivo importante per la salute pubblica e può costituire uno strumento utilizzabile dall’AIFA per classificare, ai fini dell’assegnazione alla fascia di rimborsabilità e della contrattazione del prezzo, i farmaci che si apprestano a entrare in commercio in Italia.
La suddivisione preliminare di nuovi farmaci potenzialmente valutabili ai fini dell’innovazione terapeutica deve tener conto della natura del target terapeutico.
A tale scopo sono state individuate tre classi, poste in ordine decrescente d’importanza:
- farmaci per il trattamento di malattie gravi, definendo grave una malattia che causa la morte, provoca ospedalizzazione, mette in pericolo di vita o crea una inabilità permanente (per esempio, neoplasie, morbo di Parkinson, AIDS, eccetera);
- farmaci per il trattamento di fattori di rischio per malattie gravi (per esempio, ipertensione, obesità e osteoporosi);
- farmaci per il trattamento di malattie non gravi (per esempio rinite allergica).
Un farmaco per una malattia grave non è di per sé sufficiente a definire il grado di innovazione: è importante che questo nuovo farmaco produca su tale malattia un beneficio sostanziale. Per contro, un farmaco per una malattia non grave, se riguarda patologie prive di terapia, e garantisce un buon livello di efficacia, è da considerarsi a pieno titolo un’innovazione terapeutica. Deve, inoltre, essere tenuto in considerazione anche il grado di prevalenza di tale patologia nella popolazione.
Per valutare l’innovazione terapeutica è dunque necessario valutare la disponibilità di trattamenti preesistenti e l’entità dell’effetto terapeutico.

L’autore
Dr.ssa Veronica Russo
Farmacista ospedaliero, presso l’Università degli Studi di Napoli Federico II
Bibliografia
Agenzia Italiana del Farmaco, <http://www.agenziafarmaco.gov.it/content/lista-aggiornata-dei-registri-e-dei-piani-terapeutici-web-based> (data di ultima consultazione 6 marzo 2018).
“AIFA. Legenda e Definizioni. Agenzia Italiana del Farmaco”. [Online] http://www.agenziafarmaco.gov.it/sites/default/files/Legenda_definizioni_22042016.pdf > (data di ultima consultazione 6 marzo 2018).
Ferrari e Massimino. “Diritto del Farmaco. Medicinali, diritto alla salute, politiche sanitarie”. Bar: Cacucci Editore, 2015.




