
Negoziazione e rimborsabilità dei farmaci
L’iter che porta nel nostro Paese un farmaco in farmacia è scandito da passaggi regolati e contrattazioni precise. A questo proposito AIFA svolge un ruolo fondamentale, tra le sue attività vi è la negoziazione del prezzo dei farmaci e la definizione della loro rimborsabilità da parte del Servizio Sanitario Nazionale, che avviene attraverso il supporto di due commissioni consultive composte da esperti del settore: la Commissione Tecnico scientifica e il Comitato Prezzi e Rimborso.
Data di pubblicazione: 01 gennaio 2019

L’Agenzia Italiana del Farmaco (AIFA) è un ente pubblico competente per l’attività regolatoria dei farmaci che agisce in autonomia, trasparenza ed economicità, collaborando con gli stakeholder in ambito sanitario.
Tra le attività svolte dall’AIFA, vi è la negoziazione del prezzo dei farmaci e la loro rimborsabilità da parte del Servizio Sanitario Nazionale (SSN), attraverso il supporto di due commissioni consultive composte da esperti del settore: la Commissione Tecnico scientifica (CTS) e il Comitato Prezzi e Rimborso (CPR).
L’immissione in commercio
La Commissione Tecnico Scientifica (CTS) si occupa delle attività connesse alle domande di Autorizzazione all’Immissione in Commercio (AIC) di nuovi medicinali, dei quali stabilisce anche il rapporto di costo efficacia, classificandoli ai fini della rimborsabilità in tre diverse fasce:
- la Fascia A che comprende i farmaci essenziali, interamente rimborsati dal SSN e dispensati attraverso le farmacie territoriali o le strutture sanitarie pubbliche;
- la Fascia H che comprende i farmaci di esclusivo uso ospedaliero a carico del SSN;
- la Fascia C che comprendente farmaci a totale carico del cittadino.
La CTS valuta anche se un farmaco può dimostrarsi utile per la prevenzione o il trattamento di patologie o di sintomi rilevanti per i quali non esiste una terapia efficace.
La definizione del prezzo
Il Comitato Prezzi e Rimborso (CPR) si occupa, invece, su mandato della CTS, dell’attività negoziale connessa alla rimborsabilità dei farmaci. Il CPR, attraverso la fornitura dei dati di consumi e spesa dei farmaci, è supportato dall’Osservatorio sull’Impiego dei Medicinali (OsMed), che monitora la spesa farmaceutica convenzionata a livello nazionale e regionale.
Il prezzo negoziato deve considerare alcuni, imprescindibili, aspetti:
- il volume di consumi e di spesa che presumibilmente il nuovo prodotto determinerà;
- le disponibilità finanziarie del SSN;
- i prezzi esistenti di eventuali prodotti concorrenti nella medesima area terapeutica.
Il prezzo del farmaco dovrà inoltre essere correlato al concetto di “valore del farmaco” che esprime non solo l’aspetto economico, ma anche il valore terapeutico del medicinale e, quindi, la sua efficacia e tollerabilità rispetto alle alternative esistenti.
Inizia la negoziazione
L’AIFA negozia con l’azienda farmaceutica il prezzo di rimborso da parte del SSN, sulla base dell’efficacia dimostrata negli studi registrativi. A questo proposito, la Delibera del Comitato Interministeriale per la Programmazione Economica (CIPE) n. 3 del 1 febbraio 2001 Individuazione dei criteri per la contrattazione del prezzo dei farmaci, http://www.gazzettaufficiale.it/eli/id/2001/03/28/001A3188/sg disciplina l’iter procedurale da seguire in questa negoziazione e indica la documentazione e le informazioni che il titolare dell’AIC deve fornire ad AIFA allo scopo di consentire all’Agenzia di valutare i benefici per i pazienti e la sostenibilità economica per il SSN.
Da un punto di vista fattuale, un farmaco, ottenuta l’AIC, è classificato come “farmaco di fascia C non negoziata (C-nn)”: in questa fascia sono inseriti tutti i farmaci che non sono ancora stati valutati ai fini della rimborsabilità e sono a carico del soggetto che ne richiede l’impiego.
L’iniziativa della presentazione della richiesta di negoziazione per definire il prezzo e ottenere la rimborsabilità di un farmaco appartiene all’azienda interessata, che potrà procedere in tal senso dopo il rilascio dell’AIC o del provvedimento di classificazione in fascia C-nn. La richiesta di negoziazione è analizzata dalla CTS che esprime pareri consultivi sulla classificazione dei farmaci ai fini della rimborsabilità, valutando, in particolare, se:
- esistono o meno delle terapie efficaci per una determinata patologia,
- le terapie già disponibili forniscono una risposta inadeguata o presentano comunque un peggior rapporto rischio/beneficio rispetto a quello del prodotto in esame.
Successivamente, i medicinali, che a parere della CTS sono classificati come rientranti nella fascia C, sono inviati al Consiglio di Amministrazione (CdA) dell’AIFA per la ratifica, mentre quelli considerati di fascia A o H continuano l’iter di negoziazione per l’ottenimento della rimborsabilità.
Il dossier dei farmaci, che secondo il parere della CTS devono essere considerati rimborsabili, passa quindi all’esame del CPR che si occupa della fase istruttoria, avviando le negoziazioni con l’Azienda titolare dell’AIC.
La fase istruttoria
Gli aspetti esaminati durante la fase istruttoria, piuttosto lunga e complessa, sono:
- rapporto costo/efficacia positivo, per cui il medicinale è ritenuto utile per il trattamento di patologie per le quali non esiste alcuna terapia efficace, o fornisce una risposta più adeguata rispetto a farmaci già disponibili per le medesime indicazioni terapeutiche;
- rapporto rischio/beneficio più favorevole rispetto a farmaci già disponibili per le stesse indicazioni;
- valutazione dell’impatto economico sul SSN;
- miglior costo terapia /die a confronto con prodotti della stessa efficacia;
- stima delle quote di mercato acquisibili;
- confronto con i prezzi e i consumi degli altri Paesi europei.
La ratifica e la pubblicazione in GU
Una volta raggiunto un accordo sul prezzo e sulle condizioni di ammissione alla rimborsabilità, quest’ultimo deve essere sottoposto alla CTS e, in caso di parere positivo, ratificato del Consiglio di Amministrazione dell’AIFA. Con il voto favorevole alla delibera da parte del CdA, l’accordo per la rimborsabilità del farmaco viene pubblicato sulla Gazzetta Ufficiale (GU) ed entra in vigore.
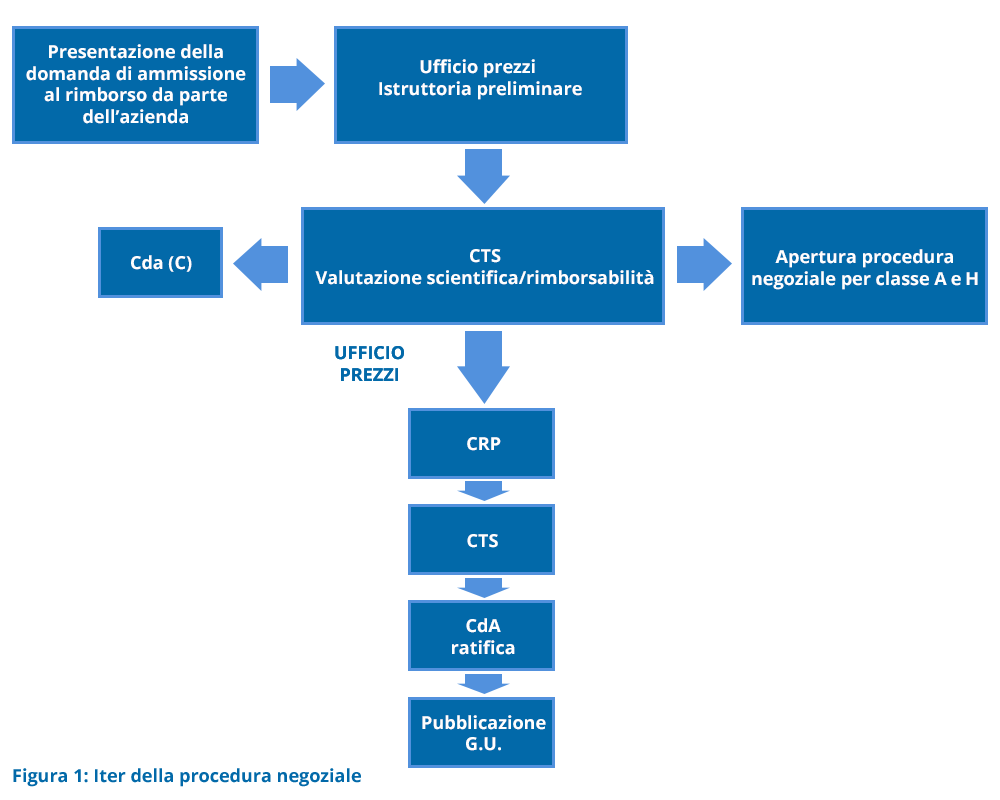
La procedura negoziale in sintesi
In Figura 1 è riportata la flow-chart dell’iter della procedura negoziale.
I vincoli
Nella procedura appena descritta incidono in modo considerevole i vincoli derivanti dalla programmazione dei tetti di spesa sanitaria; del resto, spesso, il prezzo contrattato tra un’impresa e l’AIFA non rappresenta la somma reale che verrà poi corrisposta all’industria produttrice per ogni farmaco venduto.
La stessa rimborsabilità dei farmaci, infatti, è influenzata dall’attività di monitoraggio sulla quantità del consumo e della spesa farmaceutica territoriale che, attraverso l’OsMed, è anch’essa affidata all’AIFA. In questi casi, l’AIFA contratta il prezzo del farmaco e, al contempo, vigila sul mantenimento dell’equilibrio economico relativo al tetto fissato per la spesa farmaceutica convenzionata e ospedaliera, attraverso la promozione all’impiego di farmaci equivalenti e l’applicazione del pay back in caso di sforamento.
Il sistema pay back
Il sistema pay back, introdotto con la Legge finanziaria del 2007, ha stabilito che in caso di sforamento del budget, per la spesa farmaceutica territoriale la copertura deve essere assicurata da parte dell’intera filiera (vale a dire dall’industria farmaceutica, dai grossisti e dalle farmacie) in misura proporzionale alle quote di spettanza sui prezzi dei medicinali; per la spesa ospedaliera, invece, la copertura deve essere assicurata dalle Regioni. La metodologia e i risultati ottenuti dal sistema del pay back costituiscono un valido strumento di ripiano in caso di mancato raggiungimento degli obiettivi di spesa programmata.
L’innovatività è importante
L’AIFA, previo parere della CTS, ha previsto che per l’attribuzione del carattere di innovatività di un farmaco è necessaria la dimostrazione di un valore terapeutico aggiunto rispetto alle altre terapie disponibili.
Il modello di valutazione dell’innovatività prevede un approccio multidimensionale fondato su tre elementi:
- il bisogno terapeutico;
- il valore terapeutico aggiunto;
- la qualità delle prove intesa come robustezza degli studi clinici.
Possono essere considerati innovativi i farmaci ai quali sia stata riconosciuta una qualità delle prove “alta” ed un bisogno terapeutico e un valore terapeutico aggiunto entrambi di livello “massimo” o “importante”.
L’attribuzione di livello “massimo” si raggiunge quando il farmaco è in grado di guarire la malattia o comunque di modificarne significativamente la storia naturale; il livello “importante” si ottiene quando il farmaco modifica la storia naturale della malattia in una sotto-popolazione di pazienti o rappresenta un vantaggio clinicamente rilevante rispetto alle alternative terapeutiche disponibili.
Negli ultimi anni hanno per esempio ottenuto l’autorizzazione all’immissione in commercio medicinali innovativi per l’eradicazione dell’epatite C, per la leucemia linfoblastica acuta, per il mieloma, per l’atrofia muscolare spinale.
La cura tra sostenibilità e diritti
L’elevato costo dei farmaci innovativi ha posto al centro del dibattito pubblico la necessità di coniugare la sostenibilità del sistema sanitario e il diritto di tutti i pazienti ad accedere alle nuove cure. Tuttavia, in un contesto economico-sociale caratterizzato da una endemica scarsità di risorse è stato necessario equilibrare l’impatto economico dei farmaci innovativi con la spesa farmaceutica. A questo proposito, la Legge di stabilità del 2015 ha fissato delle nuove regole per il ripiano dello sforamento del fondo aggiuntivo per la spesa per farmaci innovativi. Tale spesa, in precedenza, era a carico delle aziende farmaceutiche, in proporzione ai fatturati relativi ai medicinali non innovativi coperti da brevetto.
La Legge di stabilità del 2015 ha introdotto un’eccezione per le aziende farmaceutiche produttrici di un farmaco innovativo la cui commercializzazione abbia un fatturato superiore a 300 milioni di euro. In questo caso, viene caricata una quota parte pari al 20% dello sforamento del fondo aggiuntivo anche sull’azienda farmaceutica produttrice del farmaco innovativo, lasciando il restante 80% ripartito, ai fini del ripiano, tra tutte le aziende titolari di AIC in proporzione dei rispettivi fatturati relativi ai medicinali non innovativi coperti da brevetto.
Per il solo biennio 2015/2016, presso il Ministero della Salute, è stato destinato un fondo per concorrere al rimborso delle spese che i servizi sanitari regionali devono affrontare per l’acquisto dei medicinali innovativi. Il fondo ha beneficiato di uno stanziamento di 500 milioni di euro per ciascuno degli anni di riferimento.
A decorrere dal 1° gennaio 2017, la Legge di bilancio ha istituito due fondi, il primo per l’acquisto dei medicinali innovativi e il secondo per l’acquisto di medicinali oncologici innovativi. Tali fondi sono stati destinati al fine di garantire a tutti i pazienti l’accesso a questi farmaci senza gravare sulla spesa farmaceutica ordinaria. Entrambi i fondi hanno una dotazione di 500 milioni di euro che sono versati alle Regioni in proporzione alla spesa da loro sostenuta per l’acquisto di medicinali innovativi e innovativi oncologici presenti negli elenchi pubblicati e aggiornati dall’AIFA. Il riferimento all’inserimento in elenco è pubblicato sulla Gazzetta Ufficiale per ogni singola specialità, in relazione all’indicazione in regime di rimborso del SSN.

L’autore
Dr.ssa Enrica Menditto
Ricercatrice presso il Centro Interdipartimentale di Ricerca in Farmacoeconomia e Farmacoutilizzazione (C.I.R.F.F.) attivo presso la Facoltà di Farmacia dell’Università Federico II di Napoli
Dr.ssa Ilaria Guarino
Ricercatrice presso il Centro Interdipartimentale di Ricerca in Farmacoeconomia e Farmacoutilizzazione (C.I.R.F.F.) attivo presso la Facoltà di Farmacia dell’Università Federico II di Napoli
Bibliografia
- Deliberazione 1° febbraio 2001 – deliberazione n. 3/2001. G.U. serie generale n.73 del 28-03-2001
- Deliberazione 11° dicembre 2016, n. 232. GU Serie Generale n.297 del 21-12-2016 – Suppl. Ordinario n. 57
- Legge 23 dicembre 2014, n. 190 (legge di stabilità 2015). 14G00203 – GU Serie Generale n.300 del 29-12-2014 – Suppl. Ordinario n. 99
- Criteri per la classificazione dei farmaci innovativi, e dei farmaci oncologici innovativi, ai sensi dell’articolo 1, comma 402 della legge 11 dicembre 2016, n. 232. (Determina n.1535/2017). GU Serie Generale n.218 del 18-09-2017
- Criteri per la classificazione dei farmaci innovativi e dei farmaci oncologici innovativi (18/09/2017). Agenzia Italiana del Farmaco, AIFA. http://www.agenziafarmaco.gov.it/content/criteri-la-classificazione-dei-farmaci-innovativi-e-dei-farmaci-oncologici-innovativi-180920. Ultimo accesso 11 Novembre 2018




