Il nuovo SARS-CoV-2 e lo spillover zoonotico
Data di pubblicazione: 01 settembre 2021
Lo spillover zoonotico: cos’è
Lo spillover zoonotico, cioè la trasmissione di un agente patogeno da un animale vertebrato a un essere umano (salto di specie) è un importante problema di sanità pubblica a livello globale. Ne sono esempi significativi le zoonosi causate dal virus Ebola, dal virus dell’influenza A (H1N1), dal virus Nipah, così come le infezioni da batteri dei generi Salmonella, Leptospira, Mycobacterium, etc.1 La definizione dei fattori ambientali, ecologici e geografici in grado di favorire eventi di spillover di patogeni è fondamentale per prevedere l’insorgenza di nuove epidemie e pandemie.
Nella prima fase, la quantità di patogeno “disponibile” per l’ospite umano in un dato punto nello spazio e nel tempo, nota come “pathogen pressure”, è in grado di favorire lo sviluppo e la diffusione del patogeno al di fuori del suo ospite reservoir. In secondo luogo, il comportamento umano può contribuire in maniera significativa all’esposizione ai patogeni. Infine, gli attributi genetici, fisiologici e immunologici dell’ospite umano ricevente, insieme alla dose e alla via di esposizione, possono influenzare la probabilità e la gravità dell’infezione.1 Quindi, il rischio di insorgenza di un evento di spillover è determinato da una serie di processi che uniscono dinamiche ecologiche associate all’infezione nell’ospite reservoir, fattori legati alla sopravvivenza e alla diffusione del patogeno al di fuori del reservoir, fattori epidemiologici e comportamentali e, infine, fattori biologici in grado di influenzare la suscettibilità del ricevente.

Come detto, lo spillover zoonotico è promosso da una serie di fattori che consentono a un patogeno di un animale di stabilire un’infezione in un essere umano. Come riportato nella review di Plowright e colleghi, sono tre le principali e possibili vie di trasmissione di un patogeno dall’animale all’uomo. 1
Gli hotspot
Gli eventi di spillover sembrano concentrarsi in determinate aree del nostro pianeta, definite hotspot. Gli hotspot sono aree geografiche caratterizzate da un’elevata biodiversità e da un rapido e recente sviluppo economico, soprattutto in termini demografici e di incremento delle attività agricola e zootecniche.2
Come riportato da Allen e colleghi, in queste aree la diffusione di zoonosi e di eventuali eventi di spillover sembrano essere favoriti. 3 Questi hotspot sono particolarmente concentrati in aree tropicali e sub-tropicali con elevata densità di popolazione, con zone sempre più antropizzate e in continua espansione verso habitat naturali quali India, Cina orientale, Sudest asiatico, America centrale e divere aree dell’Africa (Figura 1). 2,3
L’intenso contatto tra l’uomo, gli animali d’allevamento e la fauna selvatica può, quindi, favorire il rischio di trasmissione di nuovi patogeni (in particolare virus) dagli animali agli esseri umani.3 Un monitoraggio e una sorveglianza continui e intensi, effettuati anche attraverso applicazioni per la ricerca automatizzata dei genomi di nuovi patogeni con potenziale zoonotico da diverse tipologie di matrici (dagli animali agli scarichi), è una delle strategie fondamentali per poter prevenire eventi di spillover.
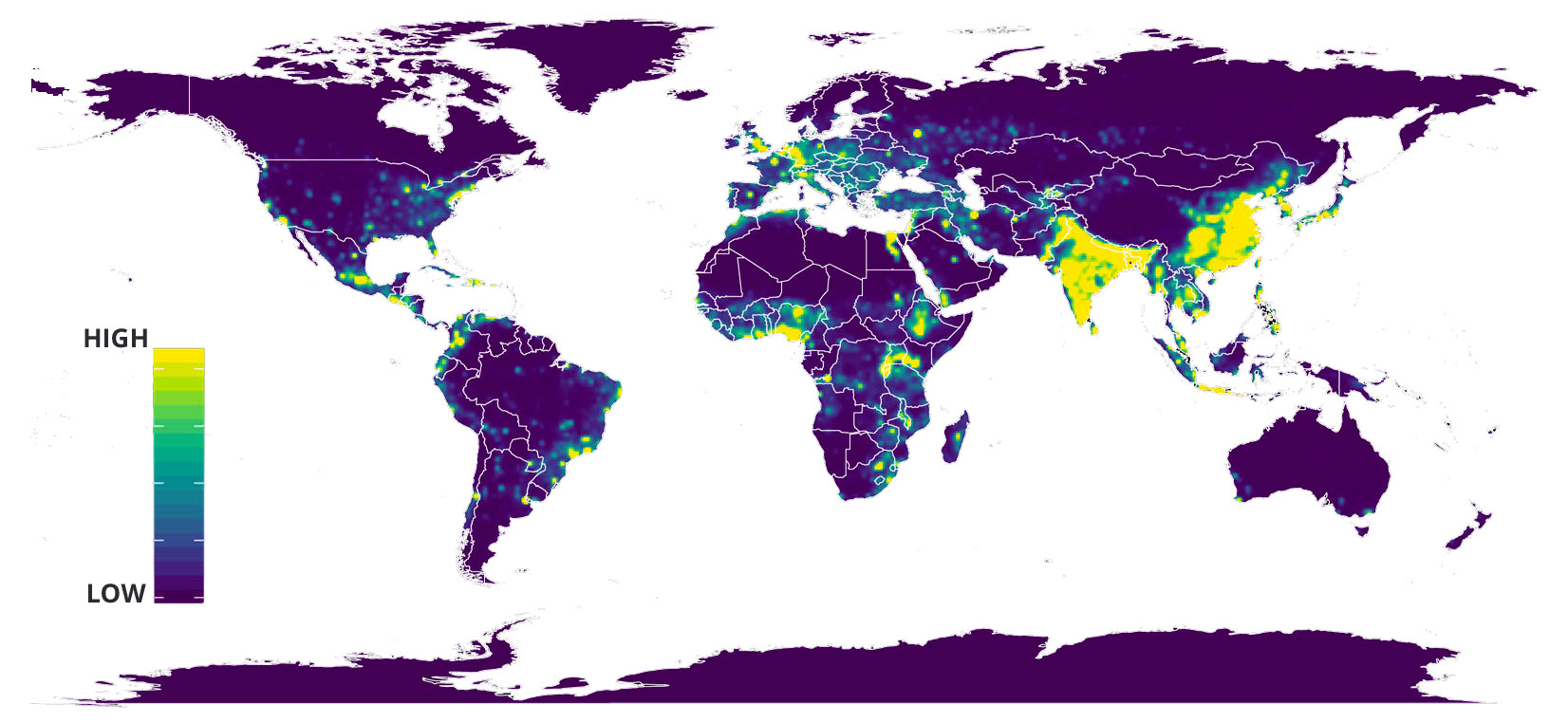
Figura 1 modificata da fig 3 ref 3. Mappa globale degli hotspot (stima del rischio dei luoghi dove potrebbe verificarsi l’evento)
Coronavirus e zoonosi: il caso di SARS-CoV-2
Come ben noto, negli ultimi 18 mesi abbiamo assistito alla diffusione su scala globale di un nuovo agente patogeno, la cui origine è stata associata a un possibile evento di spillover zoonotico. Fin dalle prime segnalazioni di una nuova forma di polmonite nella città di Wuhan (COVID-19), si è aperta un’ampia discussione sull’origine di questo virus. 4 Nel 2019, il primo focolaio di COVID-19 è stato associato a uno dei principali “wet market” di Wuhan, un mercato in cui sono venduti, tra gli altri prodotti, anche animali vivi per il consumo di carne.4
Le raccolte e le analisi dei campioni ambientali (e non animali) di virus recuperati nel mercato hanno mostrato una stretta relazione con i campioni isolati dai pazienti della stessa città. Ulteriori analisi hanno poi evidenziato che il virus potrebbe derivare da un coronavirus di pipistrello, in particolare dal coronavirus TG13 che infetta il Rinolophus affinis, un pipistrello della famiglia dei Rinolofidi. La somiglianza, a livello genomico, di SARS- CoV-2 con il virus isolato dai pipistrelli è piuttosto alta (più del 95% di identità) e sottolinea come questi due virus possano essere strettamente imparentati.4
Boni e colleghi nel luglio 2020 hanno stimato che questo livello di diversità probabilmente corrisponde a circa 20 anni di evoluzione.4 Ciò nonostante, la proteina Spike del coronavirus di pipistrello differisce da quella di SARS-CoV-2 nella sua porzione RBD (Receptor Binding Domain), la parte più variabile del genoma dei coronavirus, per cinque su sei amminoacidi fondamentali per il legame con il recettore ACE2 e per determinare lo spettro d’ospite di virus simili a SARS-CoV.5
Inoltre, come indicato dai risultati di infezioni sperimentali, anche altri animali potrebbero rappresentare potenziali ospiti di SARS-CoV-2, in particolare furetti, alcune specie di primati non umani e criceti.6 Quindi, poiché il virus è in grado di passare da alcuni animali (come il furetto) agli esseri umani, particolare attenzione è rivolta ai lavoratori con occupazioni che prevedono un rapporto uomo-animale molto stretto, come allevatori, guardiani di zoo o persone che lavorano nei macelli.
Perchè i pipistrelli?
I pipistrelli sono uno dei più importanti serbatoi naturali di coronavirus. Un articolo pubblicato nella rivista Nature evidenzia come i pipistrelli siano reservoir di molte specie virali potenzialmente trasmissibili all’uomo, con un’elevata carica virale.7 La promiscuità e il vivere in colonie molto numerose sono sicuramente due fattori che influenzano la trasmissione dei coronavirus tra i pipistrelli, probabilmente facilitando la loro evoluzione e diversificazione. Inoltre, le specie di pipistrello ad oggi conosciute sono moltissime, ognuna delle quali può interagire in maniera differente con i virus che li infettano, da qui un’ulteriore possibilità per l’origine di varianti.
SARS-CoV-2: spillover o “fuga da laboratorio” del virus?
Non dimentichiamo che esiste anche l’ipotesi che il virus SARS-CoV-2 possa essere un virus “sintetico”, creato per errore o per volontà in un laboratorio di ricerca. Proprio nel mese di maggio 2021, 18 scienziati in una lettera pubblicata su Science hanno chiesto di fare chiarezza sulle origini di questo virus, prendendo anche in considerazione l’ipotesi di uno spillover del virus da un laboratorio di biosicurezza situato in Cina. 8
Ovviamente non vi sono, ad oggi, prove che possano supportare questa teoria, ma alcuni sostengono che la vicinanza del Wuhan Institute of Virology, dove sarebbero state condotte anche ricerche sui coronavirus dei pipistrelli, con il primo focolaio di COVID-19, dovrebbe spingerci a effettuare ulteriori indagini.

Gli autori
Prof. Claudio Bandi
Dipartimento di Bioscienze, Medicina Veterinaria, Università degli Studi di Milano
Prof.ssa Sara Epis
Professore presso il Dipartimento di Bioscienze (DBS), Università degli Studi di Milano e Membro del Centro di Ricerca Coordinata in Pediatria “Romeo ed Enrica Invernizzi”, Università degli Studi di Milano.
Bibliografia
- Plowright, R. et al. Pathways to zoonotic spillover. Nat Rev Microbiol (2017); 15: 502–510.
- Lessler J et al. Perspective Piece. What is a Hotspot Anyway? J. Trop. Med. Hyg. (2017); 96(6): 1270–1273
- Allen, T et al. Global hotspots and correlates of emerging zoonotic diseases. Nature Communications (2017;)8(1): 1124
- Boni, M.F. et al. Evolutionary origins of the SARS-CoV-2 sarbecovirus lineage responsible for the COVID-19 pandemic. Nat Microbiol (2020); 5:1408–1417.
- Andersen, K.G. et al. The proximal origin of SARS-CoV-2. Nature Medicine (2020).
- do Vale, B. et al. Bats, pangolins, minks and other animals – villains or victims of SARS-CoV-2? Vet Res Commun (2021); 45:1–19.
- Olival, K. et al. Host and viral traits predict zoonotic spillover from mammals. Nature (2017); 546: 646–650.
- Bloom JD et al. Investigate the origins of COVID-19 (https://science.sciencemag.org/content/sci/372/6543/694.1.full.pdf – Ultimo accesso Giugno 2021)