Farmaco economia e politica sanitaria: Introduzione alla nomenclatura
Introduzione
Negli ultimi decenni, l’invecchiamento demografico della popolazione ha determinato un significativo cambiamento del quadro epidemiologico, caratterizzato dal prevalere delle patologie croniche ad alto impatto assistenziale.
Data di pubblicazione: 04 gennaio 2018
Questa situazione ha provocato un’enorme crescita della domanda di prestazioni sanitarie, generando un rapporto critico tra il bisogno di salute, amplificato dall’espansione dell’offerta dei servizi sanitari, e le risorse economico-finanziare che risultano essere progressivamente insufficienti.

Tale squilibrio tra domanda (bisogno di salute) ed offerta (risorse economiche disponibili) rende necessario definire quali siano le priorità da perseguire, operando delle scelte nell’ambito dei possibili interventi da finanziare.
La farmacoeconomia si propone di ottimizzare le risorse economico-finanziarie tra i possibili usi alternativi, sviluppando una tipologia d’indagine finalizzata a identificare, misurare e confrontare i costi ed i benefici relativi ai farmaci e alle altre procedure terapeutiche.
La farmacoeconomia vuole, dunque, porsi quale proficuo ausilio nella decisione all’interno del processo allocativo delle risorse.
Nello specifico, il concetto di economia su cui si basa una valutazione farmaco economica è quello di costo-opportunità, ossia il beneficio a cui si rinuncia usando quelle stesse risorse nel loro migliore impiego alternativo: destinare una risorsa ad uno specifico uso significa infatti sottrarla a qualunque altro impiego alternativo. Si avrà, pertanto, un uso efficiente delle risorse quando si riuscirà a massimizzare i benefici, minimizzando i costi.
I sette parametri chiave
I sette parametri chiave da considerare in una valutazione farmacoeconomica sono:
1. definizione dell’obiettivo dello studio e scelta della prospettiva di analisi;
Lo scopo principale della Farmacoutilizzazione è facilitare l’uso razionale dei farmaci nella popolazione. Per il singolo paziente, l’uso razionale di un farmaco implica la prescrizione di un medicinale ben documentata, a una dose ottimale, con una corretta informazione, a un prezzo accessibile. Senza una conoscenza delle modalità di prescrizione e di utilizzo dei farmaci, è, infatti, molto difficile intraprendere una discussione sul loro utilizzo razionale e suggerire misure atte a migliorare le abitudini prescrittive dei medici.
La scelta dell’obiettivo di uno studio può dipendere da una situazione specifica, in accordo con l’esigenza di fornire informazioni utili nel processo di identificazione delle priorità. Per esempio, si può verificare la necessità di conoscere i costi di un programma in uno specifico contesto organizzativo o decidere se una nuova terapia farmacologica può essere adottata o, ancora, considerare l’impatto di una futura immissione sul mercato di competitori con un costo minore (per esempio dei farmaci generici).
Una valutazione farmacoeconomica può essere condotta da diversi punti di vista (la cosiddetta prospettiva di analisi), il più ampio dei quali è la società che comprende tutti i possibili costi ed effetti. Tuttavia, una valutazione farmacoeconomica che volesse utilizzare come riferimento la società richiederebbe un tipologia di analisi molto complessa, poiché difficilmente una società nel suo insieme prende decisioni sulla distribuzione delle risorse. In realtà, la maggior parte delle valutazioni farmacoeconomiche sono realizzate dal punto di vista del terzo pagante, vale a dire dall’ente che copre la spesa sanitaria (in Italia, il Servizio Sanitario Nazionale). D’altronde, se la finalità dello studio deve essere quella di aiutare i decisori nel processo di programmazione e distribuzione delle risorse, il punto di vista dell’analisi deve essere quello di chi prende tali decisioni.
Costi di malattia
In base alla prospettiva di analisi scelta è possibile distinguere e classificare i costi come diretti, indiretti e intangibili (tabella 1).
Tabella 1. Classificazione dei costi
| TIPOLOGIA DI COSTI | SOTTOGRUPPO | ESEMPI |
|---|---|---|
| Costi diretti | Sanitari | Esami ematochimici, Esami strumentali, Visite specialistiche,Terapia farmacologica Degenza ospedaliera |
| Non sanitari | Trasporti, Diete particolari, Aiuto domestico retribuito | |
| Costi indiretti | Giorni/anni di lavoro persi dal paziente, Giorni/anni di lavoro persi dai familiari Tempo dedicato all’assistenza volontaria al paziente |
|
| Costi intangibili | Deterioramento della qualità di vita (dolore, isolamento) |
- I costi diretti si riferiscono a tutte le risorse sanitarie e non sanitarie effettivamente spese per la malattia. In particolare, sono costi diretti sanitari quelli relativi ai ricoveri, alle visite specialistiche e agli esami eseguiti per la malattia. Mentre sono costi diretti non sanitari quelli relativi all’assistenza domiciliare e ai trasporti del paziente presso i luoghi di cura.
- I costi indiretti si riferiscono, invece, all’impatto sociale conseguente alla riduzione o alla perdita di produzione da parte del paziente per malattie a breve termine, disabilità permanente o morte legata alla malattia. I costi indiretti comprendono i costi di morbilità, legati alla perdita o alla riduzione della qualità della prestazione lavorativa fornita dal paziente a causa della malattia, e i costi di mortalità, legati alla definitiva perdita di produttività dovuta alla morte prematura del paziente a causa della patologia.
- I costi intangibili, infine, si riferiscono agli effetti dell’impatto della malattia sulla qualità di vita. Nei costi intangibili sono inclusi il deterioramento della qualità di vita indotti dal dolore, i sentimenti di angoscia e gli atteggiamenti di isolamento derivanti dalla malattia.
Valorizzazione dei Costi
La valutazione dei costi indiretti e intangibili risulta essere più complessa rispetto alla valutazione dei costi diretti per i quali è relativamente semplice quantificare le risorse sanitarie e non sanitarie spese per una malattia.
Per la valorizzazione dei costi diretti sono utilizzati ad oggi tre diversi approcci: l’approccio al capitale umano, il metodo del costo frizionale e il willness to pay.
- Nel caso dell’approccio del capitale umano, la perdita di produttività è calcolata per tutta la durata del periodo di malattia o a partire dal momento della morte prematura fino al compimento dell’età pensionabile. L’individuo viene considerato come un produttore di beni o servizi, che vengono limitati o perduti a causa di disabilità e mortalità prematura. Questa metodologia, però, sottostima i costi indiretti delle malattie per tutte le categorie sociali al di fuori del mercato del lavoro o meno retribuite.
- Il metodo del costo frizionale è una tecnica di valutazione economica utilizzata per la stima dei costi indiretti legati alla mancata produttività, che si differenzia dal metodo del capitale umano. Con il metodo del costo frizionale i costi legati alla perdita di produttività sono calcolati dall’inizio della malattia (di lungo periodo) o dal decesso paziente fino a quando tale posizione lavorativa non viene nuovamente ricoperta da un’altra persona.
- Il willness to pay, infine, stima quanto il paziente sarebbe disposto a spendere per ridurre il rischio di malattia o di morte legata a una patologia. Questo dato è calcolato attraverso l’applicazione di questionari appropriati. Tale approccio, prendendo in considerazione tutti gli aspetti che possono determinare la desiderabilità di un trattamento, è utile non solo per la quantificazione dei costi indiretti, ma anche per la quantificazione dei costi intangibili. È importante sottolineare che quest’ultima non è traducibile in termini monetari e, pertanto, per la misurazione di tutti gli effetti negativi provocati da una malattia possono essere utilizzate scale di misurazione specifiche.
2. selezione delle alternative terapeutiche;
Un parametro cruciale in una valutazione di farmacoeconomia è una efficace selezione delle alternative terapeutiche da confrontare, in quanto una scelta non adeguata può inficiare la validità di tutta l’analisi. In altre parole, possono essere paragonati costi ed effetti di due alterative terapeutiche dello stesso genere, al fine di verificare quale sia il programma più efficiente sotto il profilo economico. Da un punto di vista teorico, la scelta dovrebbe ricadere tra tutte le possibili alternative esistenti in funzione di un quesito specifico. In realtà, una scelta di questo tipo è materialmente impossibile, ma si possono sviluppare i seguenti scenari:
- il confronto dei costi e degli effetti di un nuovo trattamento rispetto a quello più utilizzato nella pratica clinica (a volte inteso come il “miglior” trattamento usato), che permette di valutare l’ipotesi di introduzione di una nuova alternativa terapeutica;
- il confronto dei costi e degli effetti dell’alternativa rispetto al “nessun intervento” (o placebo), che permette di valutare in modo specifico il “valore” del trattamento;
- il confronto dei costi e dei risultati di un sistema di trattamenti o alcune forme di stepped care, che permette di valutare tutti i possibili “corsi di azione” delle alternative (analisi decisionale), con i dati relativi alle probabilità di outcomes per ogni singolo stadio.
Le terapie oggetto di analisi possono essere farmacologiche o non farmacologiche e il trattamento in esame può essere confrontato anche con l’alternativa “nessun intervento”. È tuttavia necessario ricordare che, trattandosi di una valutazione farmacoeconomica, almeno una delle alternative deve essere di natura farmacologica.
La complessità dell’analisi aumenta man mano che si passa dalle alternative farmacologiche, a quelle non farmacologiche, al “nessun intervento”, in quanto l’omogeneità tra le alternative stesse tende a diminuire.
3. scelta della tecnica di analisi;
La scelta della tecnica di analisi da utilizzare in una valutazione farmacoeconomica dipende dalla misura di outcome (conseguenza) dell’intervento e riflette il tipo di informazione che si vuole fornire agli attori del processo decisionale (tabella 2).
Tabella 2. Tipologie di tecniche di analisi
| Strategie ed obiettivi individuati dal PNP | azioni/disposizioni/strumenti “a sistema” e/o che si intendono attivare | azioni/disposizioni/strumenti “a sistema” e/o che si intendono attivare | azioni/disposizioni/strumenti “a sistema” e/o che si intendono attivare |
|---|---|---|---|
| Minimizzazione dei costi (CMA) | Monetaria | Equivalenza dimostrata in gruppi simili |
Efficienza |
| Costo efficacia (CEA) | Monetaria | Unità di effetti (es. anni di vita guadagnati; mmHg di pressione sanguigna ) |
Il modo meno costoso di raggiungere un certo obiettivo |
| Costo Utilità | Monetaria | Unità fisiche modificate per la qualità |
Qualità di vita |
| Costo beneficio | Monetaria | Monetaria | l’uso più conveniente di risorse limitate |
4. identificazione, misura e valutazione dei costi delle alternative a confronto;
Analisi di minimizzazione dei costi o CMA (Cost Minimization Analysis)
L’analisi di minimizzazione dei costi o CMA (Cost Minimization Analysis) trova applicazione quando, per le alternative a confronto, è stata dimostrata un’equivalenza terapeutica ed è possibile scegliere l’opzione con un migliore value for money. Questo tipo di analisi considera solo i costi associati ai due trattamenti e risulta limitato per ciò che concerne la valutazione delle alternative clinicamente equivalenti. L’aspetto più critico, del resto, è proprio determinare l’equivalenza terapeutica di due interventi prima di eseguire la CMA. Una volta stabilita l’equivalenza terapeutica e le dosi equi-efficaci, la CMA verrà eseguita considerando tutti i costi presenti e futuri associati ai due interventi terapeutici esaminati.
5. identificazione, misura e valutazione degli effetti delle alternative a confronto;
Analisi costo efficacia o CEA (Cost Effectiveness/Efficacy Analysis)
L’analisi di costo efficacia o CEA (Cost Effectiveness/Efficacy Analysis) si pone l’obiettivo di identificare, misurare e comparare i costi e l’efficacia di due programmi sanitari (per esempio, tra un nuovo farmaco e il farmaco abitualmente usato, o un placebo, o il migliore farmaco prima disponibile). Questa tipologia di analisi trova applicazione quando il beneficio clinico tra le due alternative in esame non è uguale e la differenza è misurabile utilizzando un’unità di misura fisica comune ad entrambe.
Le misure impiegate per valutare l’efficacia possono essere intermedie (per esempio, misurazione dei livelli di colesterolo, pressione arteriosa eccetera) o finali (per esempio, morti evitate o anni di vita salvati). I risultati di questo tipo di analisi sono dati dal rapporto tra le differenze dei costi delle due alternative considerate (CA-CB) e le differenze di efficacia (EA-EB) espresse in unità naturali (per esempio, anni di vita salvati). Pertanto, un programma è tanto più “efficace” quanto minore risulta essere il costo per unità naturale ottenuta (per esempio, costo per anno di vita salvato).
I quattro diversi scenari di una CEA sono mostrati in figura 1 (si badi lo status quo è mostrato al punto “X”):
- Se il costo dell’alternativa A è minore del costo dell’alternativa B e l’efficacia di A è maggiore dell’efficacia di B, l’intervento A è definito “dominante” in quanto rappresenta l’opzione più efficace e meno costosa e, quindi, l’alternativa A è la migliore.
- Se il costo dell’alternativa A è maggiore del costo dell’alternativa B e l’efficacia di A è minore dell’efficacia di B, l’intervento A è definito “dominato” in quanto rappresenta l’opzione meno efficace e più costosa e, quindi, l’alternativa A è la peggiore.
- Se il costo dell’alternativa A è maggiore del costo dell’alternativa B e l’efficacia di A è anch’essa maggiore dell’efficacia di B, si calcola il rapporto incrementale (ICER – Incremental Cost Effectiveness Ratio) ossia il costo aggiuntivo per unità di outcome addizionali per l’intervento A (più efficace e più costoso) rispetto all’intervento B.
- Se il costo dell’alternativa A è minore del costo dell’alternativa B e l’efficacia di A è anch’essa minore dell’efficacia di B, è necessario valutare se i benefici di B giustifichino costi più elevati.
Nell’ottica del decisore, se l’alternativa è più efficace e meno costosa, i decision makers dovrebbero optare a favore di quest’ultima, mentre dovrebbero rifiutare le opzioni che sono più costose e meno efficaci. I trade-offs sono meno chiari nei rimanenti due scenari e richiedono ai decision makers di valutare se i benefici che potrebbero essere guadagnati da uno specifico trattamento giustifichino il maggior investimento. Occorre cioè verificare se il valore dell’ICER si collochi al di sopra o al di sotto della soglia di accettabilità, ossia del valore massimo stabilito di disponibilità a pagare per ottenere un’unità addizionale di outcome. Un limite dell’analisi costo/efficacia è di permettere il confronto solo tra alternative i cui risultati sono riconducibili alla medesima unità di misura (per esempio, i trattamenti dell’insufficienza renale mediante dialisi o trapianto hanno in comune lo scopo di prolungare la vita del paziente). Inoltre, l’analisi costo efficacia considera solo i risultati delle diverse alternative in termini quantitativi (per esempio, l’utilizzo di risorse, sopravvivenza espressa in termini di quantità) senza tener conto delle variazioni che vi possono essere in termini qualitativi (per esempio, il trapianto renale rispetto alla dialisi non comporta solo un aumento della sopravvivenza ma anche un miglioramento della qualità di vita del paziente).
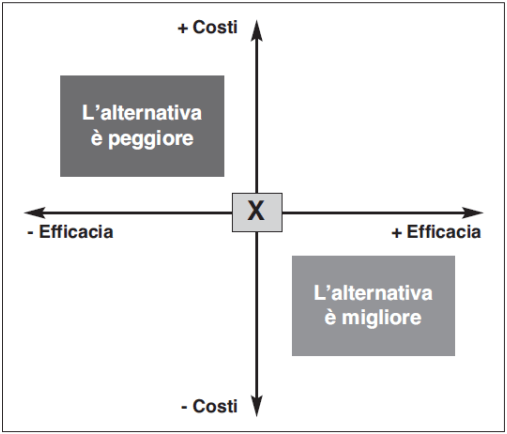
Figura 1. Scenari possibili di una CEA
Analisi costo utilità o CUA (Cost Utility Analysis)
L’analisi costo utilità o CUA (Cost Utility Analysis) si utilizza nel momento in cui la scelta di un determinato intervento terapeutico deve essere fatta non solo in funzione dell’obiettivo quantitativo da raggiungere, ma, anche, dell’obiettivo qualitativo. Questa tipologia di analisi trova applicazione se la differenza tra due alternative ha come discriminante la qualità di vita del paziente. Per esempio, se il confronto riguarda due programmi alternativi per il trattamento dell’artrite, l’outcome di interesse non è il tasso di mortalità quanto piuttosto il verificare che il programma migliori effettivamente la funzionalità articolare e, dunque, la qualità di vita del paziente.
La CUA permette di confrontare alternative anche molto diverse tra di loro esprimendo gli effetti di un intervento in termini di un outcome composito che misura sia la “quantità” sia la “qualità” di vita generata dalla realizzazione di un intervento terapeutico (QALY – Quality Adjusted Life Year).
Il termine QALY è stato definito dall’istituto britannico NICE (National Institute for health and Clinical Excellence) come “la misura della durata della vita di un soggetto pesata per la qualità di vita ad essa associata”. Tale misura si ottiene dal prodotto aritmetico dell’aspettativa di vita, guadagnata grazie a un trattamento, e l’indice di utilità rispetto alla qualità di vita. L’indice di utilità esprime, infatti, la desiderabilità di una condizione di salute. Questo indice può assumere valori compresi tra 0 (morte immediata) e 1 (stato di perfetta salute).
Il risultato finale di una CUA è espresso come costo per QALY guadagnato a seguito della realizzazione di un trattamento rispetto ad un altro e indica il costo addizionale richiesto per produrre un anno di vita in perfetta salute (1 QALY).
Il costo per QALY è calcolato come differenza tra i costi attesi dei due interventi diviso la differenza tra i QALY attesi prodotti dai due interventi. In genere, i metodi che consentono di assegnare un peso (utilità) ai diversi possibili livelli di qualità degli anni di vita guadagnati si basano sul giudizio soggettivo. L’utilità di uno stato di salute varia a seconda del soggetto a cui si pone la domanda, dal modo in cui la domanda viene posta e dal modo in cui viene descritto lo stato di salute. I metodi di valutazione della qualità di vita si dividono in metodi diretti (il Time Trade-off, lo Standard Gamble e il Rating Scale) e indiretti (soprattutto questionari) che possono essere suddivisi in specifici e generici (EuroQol).
Analisi di costo beneficio o CBA (Cost Benefit Analysis)
L’analisi costo beneficio o CBA (Cost Benefit Analysis) si applica quando gli effetti di due o più alternative non sono direttamente paragonabili tra di loro. Tale tecnica di analisi è utile quando vi è un ampio ventaglio di diversi outcome correlati ai due interventi a confronto. Il risultato di una CBA è espresso in termini di beneficio o costo netto (differenza tra costi e benefici) o di un rapporto in cui sia il numeratore (costi) sia il denominatore (benefici) siano tradotti in unità monetarie.
In teoria, la CBA è la più potente tra le tecniche di analisi perché consente di superare i problemi dell’efficienza allocativa attraverso un confronto diretto tra costi e benefici. Risulta, tuttavia, difficile e talora concettualmente opinabile tradurre il “guadagno in salute” in termini monetari, e, pertanto, nella pratica, questa tecnica è ancora poco applicata.
6. aggiustamento dei costi e degli effetti in base all'orizzonte temporale dello studio;
La realizzazione di un programma sanitario rappresenta un investimento che comporta costi e benefici distribuiti nel tempo. In una valutazione farmacoeconomica corretta, tali elementi devono essere ponderati (attualizzati) per esprimere valori comparabili. Questo perché il valore di mille euro odierni potrebbe per esempio modificarsi tra due anni a causa dell’atteggiamento di alcuni agenti, come l’inflazione, capaci di ridurre il potere di acquisto del denaro. La ponderazione converte l’ammontare dei costi e dei benefici nel loro valore attuale, con il ricorso ad un tasso di sconto, utilizzando la seguente formula:
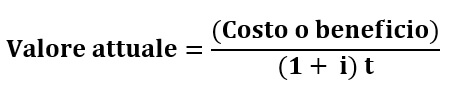
Il valore attuale deve essere calcolato per ogni singolo costo o beneficio, considerando un tasso di sconto (i) ed un tempo (t) espresso in anni. Il tasso di sconto rappresenta un tasso di rendimento per investimenti simili, anche in termini di rischio, preso dal mercato dei capitali.
Il valore attuale dei costi sarà dato dalla somma dei valori attuali di tutti i costi, mentre il valore attuale dei benefici sarà dato dalla somma dei valori attuali di tutti i benefici. Costi ed effetti che si manifestano oltre un anno dopo l’intervento devono essere scontati allo stesso tasso sociale di sconto. In genere, il tasso di sconto utilizzato è il 3%.
7. analisi di sensibilità.
Al fine di valutare la “robustezza” dei risultati della valutazione economica, è necessario procedere ad una analisi di sensibilità, un procedimento attraverso cui vengono identificati tutti i parametri che influiscono direttamente ed in maniera considerevole sui costi ed i risultati.
Attraverso l’analisi di sensibilità tutti i parametri usati vengono fatti variare. È possibile effettuare analisi univariate, modificando un parametro per volta, o multivariate, modificando più parametri contemporaneamente. In quest’ultimo caso, è possibile calcolare il caso migliore (minori costi per la nuova alternativa e maggiore efficacia) e il caso peggiore (maggiori costi e peggiore efficacia). Lo studio sarà definito “robusto” se le sue conclusioni non vengono sostanzialmente modificate da tali variazioni.

L’autore
Dr.ssa Enrica Menditto
Ricercatrice presso il Centro Interdipartimentale di Ricerca in Farmacoeconomia e Farmacoutilizzazione (C.I.R.F.F.) attivo presso la Facoltà di Farmacia dell’Università Federico II di Napoli