
Analisi percorsi diagnostico terapeutici del carcinoma mammario
Dalla teoria alla pratica: l’applicazione di strategie di screening e di gestione del carcinoma mammario (progetto INDEX)
Data di pubblicazione: 02 maggio 2018
Introduzione
Il cancro al seno è, a livello mondiale, il secondo tumore più comune dopo il cancro ai polmoni. Si stima che nel 2017 siano stati diagnosticati in Italia circa 50.500 nuovi casi di carcinoma mammario (1).

Nel 2014 invece sono stati registrati 12.201 decessi per tumore al seno ed ha quindi rappresentato la prima causa di morte nelle donne (2). In Italia, la sopravvivenza a 5 anni risulta essere pari all’87%, mentre dopo 10 anni dalla diagnosi è pari all’80%.
Sono stati identificati diversi fattori di rischio legati al carcinoma mammario: fattori riproduttivi (menarca precoce e una menopausa tardiva; nulliparità, una prima gravidanza a termine dopo i 30 anni, il mancato allattamento al seno), fattori ormonali (terapia ormonale sostitutiva assunta durante la menopausa), fattori dietetici e metabolici (elevato consumo di alcool e di grassi animali e basso consumo di fibre vegetali), pregressa radioterapia (a livello toracico e specialmente se prima dei 30 anni d’età) e precedenti displasie o neoplasie mammarie. Inoltre, il 5%-7% dei tumori mammari risulta essere legato a fattori ereditari, un quarto dei quali determinati dalla mutazione di due geni, BRCA 1 e/o BRCA 2 (3).
Il trend di incidenza del tumore della mammella in Italia appare in leggero aumento (+0,9% per anno), mentre continua a calare, in maniera significativa, la mortalità (-2,2% per anno).
L’ampliamento della popolazione target dello screening mammografico in alcune regioni (tra cui Emilia-Romagna e Piemonte), rende ragione dell’aumento significativo dell’incidenza della neoplasia nella classe di età 45-49, dove di contro la mortalità si abbassa dell’1,6%.
Si tratta di un dato medio valido anche a livello nazionale che può tuttavia variare da regione a regione (4-5).
Nella figura 1 si riportano le fasce d’età delle donne coinvolte nella fase di screening per lo studio INDEX della regione Lombardia (6).
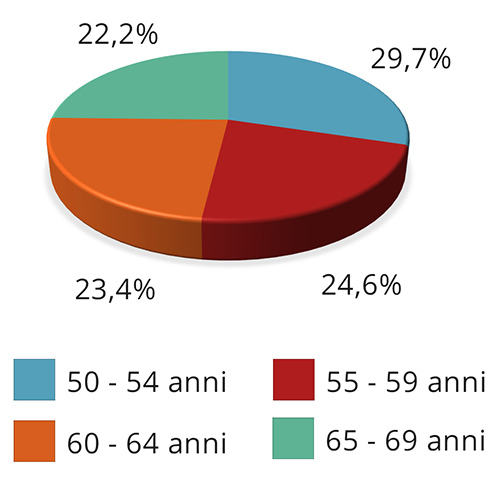
Figura 1 – Diagnostica anticipata: distribuzione delle donne invitate a screening per la regione Lombardia
La qualità di vita
Negli ultimi 10-20 anni la qualità di vita (QoL) è diventata un indicatore estremamente importante nella valutazione delle pazienti con tumore al seno, tanto da essere incluso, in molti casi, come end-point secondario nei più recenti studi clinici randomizzati. La valutazione dell’impatto della neoplasia sulla QoL può contribuire alla scelta del trattamento più appropriato e può rappresentare un fattore prognostico, al pari di altri determinanti di esito clinico.
Il tumore al seno è probabilmente una delle condizioni patologiche in cui è più significativa la relazione con la QoL. L’anticipazione della diagnosi migliora la prognosi delle pazienti, che in molti casi sopravvivono a lungo, rendendo quindi la valutazione della qualità di vita un fattore di rilievo. Inoltre, la diagnosi stessa e gli interventi chirurgici spesso non conservativi hanno un impatto negativo sull’identità femminile, causando depressione oltre che una comprensibile paura per il futuro.
Nel corso degli anni, anche gli obiettivi di trattamento descritti nelle Linee Guida si sono adeguati includendo il concetto di QoL nella definizione delle strategie terapeutiche e gestionali. Ad esempio, le Linee Guida dell’Associazione Italiana di Oncologia Medica (AIOM) sottolineano come il prolungamento della sopravvivenza e del miglioramento dei sintomi, debbano essere bilanciati con il mantenimento di un’adeguata qualità di vita e con una tossicità accettabile (7-9).
I costi di gestione del carcinoma mammario
Nonostante il consumo di risorse ed i costi attribuibili al tumore al seno siano stati ampiamente valutati in ambito internazionale, i dati italiani in quest’ambito sono piuttosto modesti.
Dalla letteratura internazionale si evince che l’impatto economico del tumore al seno è considerevole, nonostante esista una rilevante variabilità tra le nazioni che riflette condizioni di offerta sanitaria non sempre omogenee. L’avvento delle terapie biologiche, i progressi nella diagnosi precoce, e in generale il progressivo miglioramento del processo d’assistenza hanno determinato un rapido incremento dei costi. L’argomento costi è assai dibattuto negli Stai Uniti. Una recente revisione sistematica di 29 studi sul costo della malattia ha mostrato che il costo “lifetime” della paziente con tumore al seno varia in un ampio range, tra 20.000 e 100.000 dollari. I principali driver di spesa, per questa malattia, sono gli interventi chirurgici (chirurgia conservativa e mastectomia) e la somministrazione dei trattamenti.
Diversi studi hanno dimostrato un aumento dei costi associato all’evoluzione dello stadio della malattia e una diminuzione dei costi legata invece all’aumento dell’età alla diagnosi. I costi indiretti (come l’impatto sull’attività lavorativa) per perdita di produttività sono tanto rilevanti quanto i costi diretti (come trattamento, ospedalizzazione, indagini diagnostiche), dal momento che molte donne si ammalano in età adulta, nel pieno della loro attività lavorativa (10).
IL PROGETTO INDEX
La FIASO (Federazione Italiana Aziende Sanitarie e Ospedaliere) e CIPOMO (Collegio Italiano dei Primari Oncologi Ospedalieri) hanno realizzato nel 2010 il progetto INDEX (6), una valutazione d’indicatori di processo, di percorso diagnostico, terapeutico e assistenziale nell’ambito della gestione del carcinoma mammario in Lombardia con i seguenti obiettivi:
- stimare l’attuale quadro epidemiologico, clinico ed economico del carcinoma mammario in Lombardia;
- valutare, attraverso la definizione di una serie di indicatori di processo ed esito (riconosciuti dalla comunità scientifica oncologica), il percorso di diagnosi e cura delle pazienti con carcinoma mammario;
- analizzare il livello di allineamento di tali indicatori con gli standard considerati clinicamente accettabili dalle Linee Guida nazionali e internazionali sul carcinoma mammario;
- confrontare gli indicatori di processo e di esito, laddove possibile, con i risultati di studi simili condotti in altre realtà italiane;
- valutare la variabilità regionale, confrontando sia i dati d’impatto epidemiologico, sia gli indicatori di PDTA nelle varie ASL che hanno partecipato allo studio, tentando di fornire delle spiegazioni plausibili relativamente alle possibili differenze;
- approfondire, in ultima analisi, le aree di criticità del percorso (es. inadeguato screening oncologico, utilizzo non appropriato delle risorse economiche) e suggerire strategie di miglioramento.
Risultati - Diagnostica anticipata
Delle 368.416 donne invitate allo screening mammografico, 206.388 hanno poi eseguito il test. Il tasso grezzo di adesione è risultato pari al 56,02%. In termini assoluti, questo valore può considerarsi non ancora soddisfacente, seppur in linea con la media nazionale italiana, pari al 55% e registrata nel 2009 attraverso l’Osservatorio Nazionale di Screening.
L’esito del test dello screening mammografico è stato recuperato in 174.271 casi (84,44% del totale degli screening effettuati). L’esito dello screening è stato negativo in 167.060 casi (95,86% del totale degli screening) e positivo nei restanti 7.211 (4,14%).
Nella quasi totalità di questa coorte è stato inoltre possibile misurare il tempo intercorso tra la visita di screening e l’esito della visita stessa. Il tempo medio d’attesa è stato pari a 14,86 giorni nel gruppo di pazienti che hanno avuto esito negativo, e di 18,59 giorni il tempo intercorso tra il primo screening e la visita di approfondimento, nel gruppo di pazienti che ha avuto un esito positivo.
Il richiamo per approfondimenti post-mammografici è stato effettuato in 10.060 donne delle 206.388 valutate, con un conseguente tasso del 4,87%. Questo dato può essere messo in correlazione con il tasso grezzo d’identificazione diagnostica (detection rate – la proporzione di individui affetti da una specifica patologia che risultano positivi al test/screening se misurati con una metodologia gold standard), che è risultato pari al 4,11%.
Il rapporto tra i due tassi consente di identificare un dato interessante: ogni 10 richiami di approfondimento, si diagnostica approssimativamente un caso di tumore (mammario). Da notare che questo dato può essere molto variabile anche in funzione del tipo di tumore, della dimensione e di quanto risulta invasivo. Pertanto l’expertise di un centro a livello di tecniche diagnostiche è rilevante nell’aumentare il numero di casi positivi post-richiamo.
Un altro parametro che può fornire interessanti informazioni è il cancro d’intervallo: si tratta di un carcinoma che compare dopo un processo di screening risultato negativo e prima del passaggio di screening successivo. È legato sia ai limiti del test (quindi alla possibilità di avere falsi negativi) sia all’errore umano, sempre possibile nella pratica medica.
Ad esempio, in un’analisi della misurazione dei cancri intervallo condotta su 121.919 donne, di età compresa tra i 50 e i 69 anni, che hanno effettuato un test mammografico nel periodo gennaio-dicembre 2006 (con risultato negativo), sono stati diagnosticati 166 cancri d’intervallo, nei due anni successivi allo screening.
Questo dato porta a concludere che l’obiettivo diagnostico deve essere quello di minimizzare l’occorrenza di questi episodi, migliorando la qualità dello screening e diagnosticando il tumore quanto più precocemente. Di contro, l’evoluzione di un tumore in certe situazioni può essere così imprevedibile e veloce da sfuggire a controlli che si implementano generalmente su base biennale.
Risultati - Diagnostica clinica
Nello studio INDEX è stato inoltre valutato il processo diagnostico in una popolazione di donne indirizzate a intervento chirurgico di asportazione del tumore primitivo nell’anno 2008 (campione di 5.056 donne).
Queste pazienti sono state sottoposte ad una serie di accertamenti diagnostici nei tre mesi precedenti all’intervento (Tabella 1).
| Esame diagnostico | Frequenza (N) | Frequenza (%) |
|---|---|---|
| Valutazione dei linfonodi sentinella | 3.106 | 61,43 |
| Ago aspirato o ago biopsia | 2.189 | 43,30 |
| Risonanza magnetica Nucleare | 174 | 3,44 |
| Tomografia Assiale Computerizzata | 124 | 2,45 |
| Tomoscintigrafia Globale Corporea | 104 | 2,06 |
| Totale pazienti | 5.056 | – |
Tabella 1 – Diagnostica clinica: Frequenza di esami diagnostici effettuati nei tre mesi precedenti all’intervento (n=5.056) in Lombardia
La frequenza relativa degli esami ad alto costo unitario (PET, RMN, TC), valutata nello studio INDEX, è risultata molto contenuta (range 2-3%) e compatibile con una casistica specifica per cui l’esame potrebbe anche essere suggerito. Conseguentemente, il carico economico complessivo per esami potenzialmente inappropriati ha impattato in maniera non particolarmente importante sul budget del Servizio Sanitario Regionale, essendo stato pari a:
- € 112.513 per le tomo-scintigrafie globali corporee, o PET (costo unitario: € 1.081,86);
- € 43.872 per le risonanze magnetiche nucleari (costo unitario: € 252,14);
- € 12.445 per le tomografie assiali computerizzate (costo unitario: € 100,36).
In generale, risulta importante valutare l’appropriatezza/inappropriatezza di un’indagine diagnostica aggiuntiva, cercando di stabilire quando un ulteriore accertamento possa essere evitato in quanto non andrebbe ad aggiungere nuove informazioni rispetto a quelle raccolte in fase di diagnosi. La valutazione deve naturalmente tenere conto dei costi per la ASL e il Sistema Sanitario Nazionale.
Anche secondo le Linee Guida AIOM del 2009, l’indirizzo è quello di non raccomandare (salvo casi specifici) un assessment diagnostico in pazienti che saranno a breve sottoposte ad asportazione del tumore e che pertanto hanno già un’indicazione rilevante al trattamento chirurgico.
Risultati - Trattamento del tumore primitivo
È stato preso in considerazione un campione di pazienti con carcinoma mammario sottoposte ad asportazione chirurgica del tumore: 2.669 donne operate nel semestre gennaio-giugno 2008. Il dettaglio sul tipo di intervento è mostrato in Figura 2.
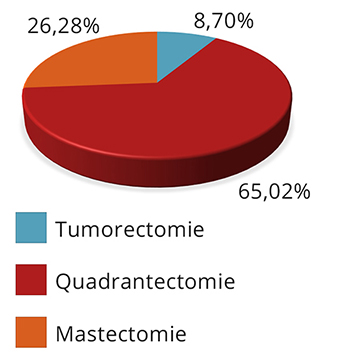
Figura 2 – Chirurgia del tumore primitivo: percentuale relativa al tipo di operazione (n pazienti=2.669)
Il primo indicatore valutato è stato il tempo medio intercorso tra la diagnosi e l’intervento chirurgico che è risultato di poco inferiore ai 3 mesi (media: 81,10 giorni). La percentuale di pazienti operate entro 30 giorni dalla data della mammografia (che ha fornito un riscontro positivo e l’eleggibilità all’intervento chirurgico) è stata pari al 26,48%. Nello studio INDEX il tempo medio di attesa è di circa 40-50 giorni, con una variabilità tra le ASL non particolarmente elevata (Figura 3).
Tuttavia il tempo raccomandato è di 30 giorni. Il ritardo (di 10-20 giorni) è plausibilmente dovuto a una richiesta di assistenza superiore rispetto a quella che le ASL possono affrontare con le attuali risorse strutturali, determinando, in casi sporadici, attese superiori alle raccomandazioni.
Mediamente, il tempo intercorso tra l’intervento chirurgico e l’inizio del trattamento farmacologico è stato di 58.50 giorni, e soltanto il 19,60% delle pazienti ha iniziato il trattamento entro il primo mese dall’intervento.
È possibile che le strutture ospedaliere siano obbligate a ritardare l’inizio delle terapie per problemi di understaffing, ma potrebbero coesistere decisioni cliniche dietro la scelta di posticipare l’inizio del trattamento farmacologico. Ancora una volta la variabile tempo d’attesa potrebbe dipendere da fattori non esclusivamente organizzativi. In quest’ottica ha senso interrogarsi sia sulla natura di questi fattori, sia sulla determinazione di quali fattori causino la dispersione dei valori in ogni singola ASL.
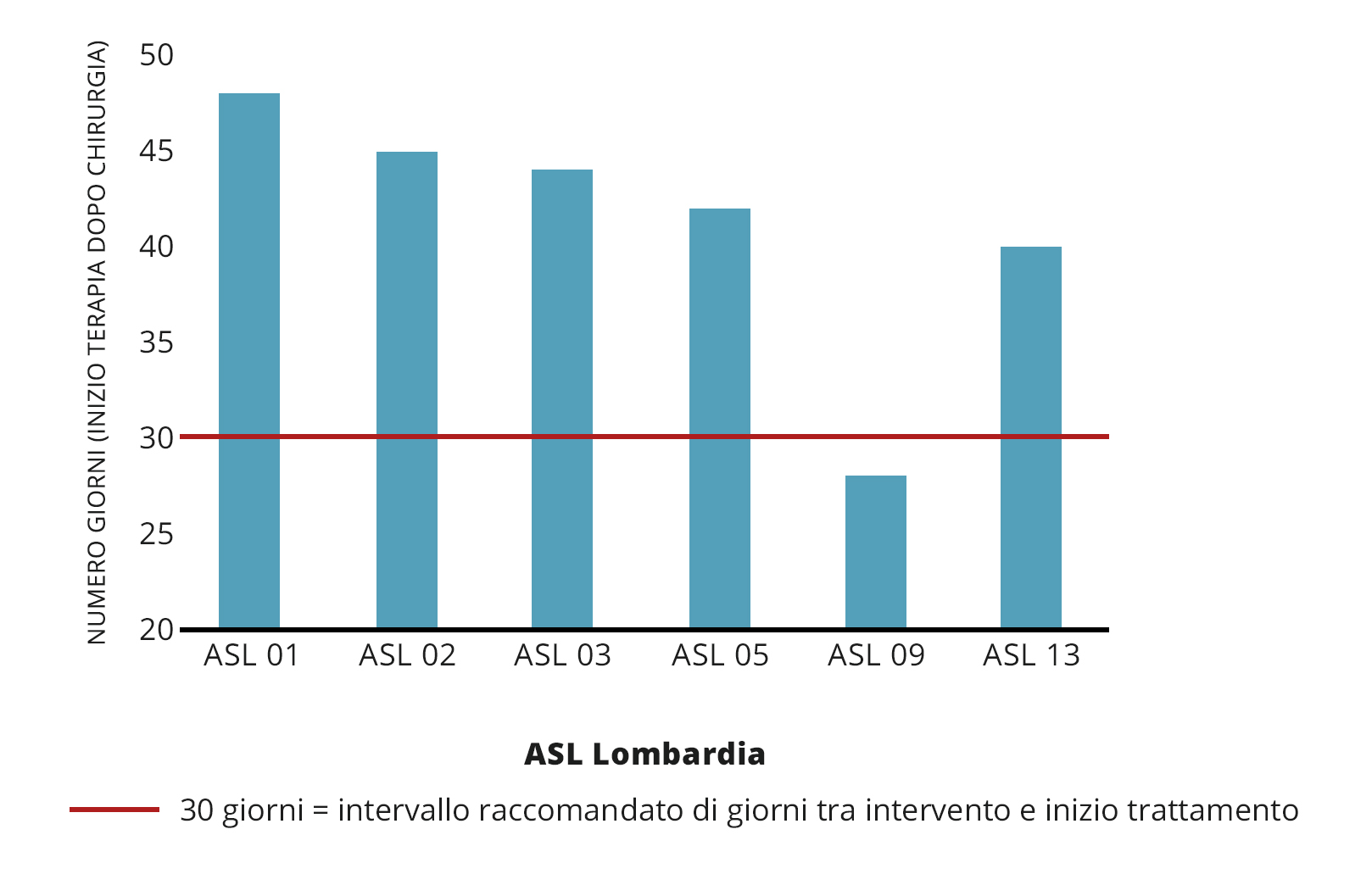 Figura 3 – Trattamento del tumore primitivo: tempo d’attesa per l’inizio del trattamento farmacologico post-intervento, per ASL d’appartenenza (n pazienti=539)
Figura 3 – Trattamento del tumore primitivo: tempo d’attesa per l’inizio del trattamento farmacologico post-intervento, per ASL d’appartenenza (n pazienti=539)
Risultati - Follow-up post intervento
Nel periodo di riferimento luglio – dicembre 2007, sono state selezionate 2.390 donne sottoposte a intervento chirurgico e senza una recidiva nel periodo luglio 2008 – giugno 2009. Complessivamente, sono stati eseguiti 8.457 esami (in media 3,54 per paziente operata).
Indicativamente, 1 paziente su 5 ha effettuato una scintigrafia ossea e 1 su 10 una tomografia assiale. Ad esempio l’aggravio per scintigrafie ossee è pari a euro 76.237, cifra importante in valore assoluto, ma non particolarmente rilevante se messa in correlazione con l’ammontare delle risorse sanitarie allocate da una ASL per l’oncologia (Tabella 2).
| ASL (N donne operate) | Numero esami (N) | Numero esami per pz operata |
|---|---|---|
| Esami CEA e/o CA | 4.400 | 1,84 |
| Mammografia | 1.780 | 0,74 |
| Ecografia addominale | 1.592 | 0,67 |
| Scintigrafia ossea total body | 472 | 0,20 |
| Tomografia assiale computerizzata | 213 | 0,09 |
| Totale esami | 8.457 | 3,54 |
Tabella 2 – Follow-up post-intervento: frequenza degli esami di follow-up (n pazienti=2.390)
Le Linee Guida AIOM 2009 affermano che “non esiste un’evidenza che l’esecuzione di esami di routine quali esame emocromocitometrico, profilo biochimico, radiografia del torace, scintigrafia ossea, ecografia epatica, marcatori tumorali, possa portare a dei reali benefici nella gestione del tumore della mammella”.
La considerazione da fare è quindi che risulta importante monitorare il rischio di inappropriatezza anche per quegli esami o indagini a costo unitario basso o medio-basso, poiché se effettuati in numero elevato possono gravare sul budget sanitario. Il lavoro in team multidisciplinare potrebbe ad esempio favorire la scelta adeguata degli step da seguire per il follow up del paziente, andando ad eseguire gli accertamenti più idonei a verificare l’evoluzione del tumore (stabilità, remissione, progressione).
Il progetto INDEX è un esempio di come gli strumenti informativi a disposizione di una ASL possano essere opportunamente impiegati per:
- ottenere informazioni sulla qualità del processo assistenziale;
- individuare le aree di eccellenza e quelle di miglioramento;
- porre in essere interventi correttivi per aumentare l’efficienza e ridurre, laddove possibile, gli sprechi.
Le fonti di dati impiegate in quest’analisi consentono di individuare, in maniera rapida e poco costosa, potenziali aree di inappropriatezza, ad alto impatto clinico o assorbimento di risorse, che meritano un accurato approfondimento.
Quest’approfondimento dev’essere mirato alla comprensione dei fattori “reali” che hanno determinato il risultato di performance sintetizzato dall’indicatore. In particolare, il responsabile della valutazione d’analisi ha il compito di escludere che l’eventuale valore distorto (o peggio, l’outlier) sia dovuto a un errore metodologico insito nella modalità di raccolta dati, nell’errata interpretazione di un criterio di inclusione/esclusione, nell’errata implementazione di una query.
In definitiva, dalla analisi descritta è possibile affermare che:
- le ASL della Lombardia sembrano avere, mediamente, una buona performance sia nell’area dello screening che del trattamento e gestione del carcinoma mammario, anche se esistono delle aree di miglioramento e di riduzione degli interventi inappropriati, specie nella diagnostica;
- i tempi d’attesa per l’intervento chirurgico di resezione del tumore e per l’inizio dei trattamenti non sono ancora pienamente soddisfacenti, anche se c’è ragione di credere che la performance sia comunque migliore di quella media nazionale;
- esistono delle aree d’inappropriatezza economica e di possibile risparmio (e riallocazione di risorse) per il Servizio Sanitario Regionale, anche se questo specifico aspetto richiederebbe ulteriori approfondimenti e nuove analisi mirate a valutare con più attenzione il piano che ha determinato l’esecuzione di questi interventi. Da considerarsi un fenomeno piuttosto contenuto e con un impatto moderatamente basso sul budget della ASL.

L’autore
Dr. Alessandro Monaco
Professionista nel campo Healthcare – Biomedical research, Regulatory practices, Organizational outcome
Bibliografia
- http://www.registri-tumori.it/cms/ (Data ultimo accesso 09.02.2018)
- ISTAT, 2017 – https://www.istat.it/it/archivio/207188
- http://www.aiom.it/fondazione-aiom/+aiom-airtum-numeri-cancro-2017/1,3021,0, (Data ultimo accesso 09.02.2018)
- ISTAT 2017 – Report: L’evoluzione Della Mortalità Per Causa: Le Prime 25 Cause Di Morte – http://www.istat.it/it/files/2017/05/Report-cause-di-morte-2003-14.pdf
- https://www.osservatorionazionalescreening.it/content/screening-mammografico (Data ultimo accesso 09.02.2018)
- Il progetto INDEX: indicatori di processo diagnostico, terapeutico, assistenziale (PDTA) nel carcinoma mammario – https://www.fiaso.it/Pubblicazioni/Il-progetto-Index-indicatori-di-processo-diagnostico-terapeutico-assistenziale-PDTA-nel-carcinoma-mammario
- Kim TH, Chang JS, Kong ID. Effects of Exercise Training on Physical Fitness and Biomarker Levels in Breast Cancer Survivors. J Lifestyle Med. 2017 Jul;7(2):55-62. – https://www.ncbi.nlm.nih.gov/pubmed/29026725
- Syrowatka A, Motulsky A, Kurteva S, Hanley JA, Dixon WG, Meguerditchian AN, Tamblyn R. Predictors of distress in female breast cancer survivors: a systematic review. Breast Cancer Res Treat. 2017 Sep;165(2):229-245. – https://www.ncbi.nlm.nih.gov/pubmed/28553684
- Cheng KKF, Lim YTE, Koh ZM, Tam WWS. Home-based multidimensional survivorship programmes for breast cancer survivors. Cochrane Database Syst Rev. 2017 Aug 24;8:CD011152. – https://www.ncbi.nlm.nih.gov/pubmed/?term=Home-based+multidimensional+survivorship+programmes+for+breast+cancer+survivors
- Breast cancer: Challenges, controversies, breakthroughs. Nat. Rev. Dec 2010 – https://www.ncbi.nlm.nih.gov/pubmed/?term=2.%09Breast+cancer%3A+Challenges%2C+controversies%2C+breakthroughs.+Nat.+Rev.+Dec+2010
- http://www.epicentro.iss.it/discussioni/cancri_intervallo/zappa.asp , (Data ultimo accesso 09.02.2018)




